Пересадка костного мозга. показания к пересадке костного мозга, подготовка к операции и послеоперационная реабилитация
Содержание:
- Исследование ликвора. Люмбальная пункция
- Противопоказания к пересадке костного мозга
- Симптомы
- Что такое костный мозг
- Как происходит пересадка костного мозга?
- Исследование костного мозга и системы крови
- 3.Заболевания костного мозга
- 4.Лечение болезни
- Как стать донором костного мозга и кто может это сделать?
- Оценка эффекта проведённого лечения
- Васкуляризация. Иннервация. Возрастные изменения. Регенерация.
- Дифференциальная диагностика
- Осложнения при пересадке костного мозга. «Трансплантат против хозяина»
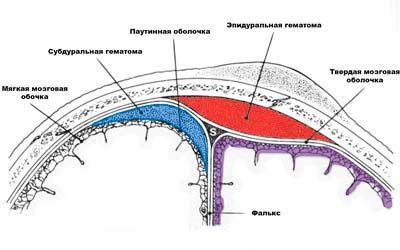
Исследование ликвора. Люмбальная пункция
Исследование ликвора – один из самых достоверных методов лабораторной диагностики воспалительных и аутоиммунных заболеваний нервной системы. Чтобы точно выявить целесообразность исследования и обезопасить Вас от нежелательных последствий мы выполняем исследование ликвора только по назначению врача нашей клиники после проведения соответствующей подготовки. Мы осуществляем люмбальную пункцию амбулаторно, если к пункции нет противопоказаний. После пункции мы оставим Вас в палате под наблюдением медицинского персонала на несколько часов (обычно около 5).
Для выполнения пункции нам понадобятся:
МР-томография головного мозга (не только заключение, но и снимки на пленках или дисках), давностью не более 3х месяцев. Это важно для Вашей безопасности: при некоторых заболеваниях и врожденных аномалиях мозга люмбальная пункция слишком рискованна. При нечеткости снимков мы оставляем за собой право попросить Вас их переделать.
Осмотр неврологом в нашей клинике. Врач, который будет выполнять пункцию должен точно понимать показания к исследованию, уровень безопасности пункции в Вашем случае и пути предупреждения побочных эффектов.. Мы выполняем люмбальную пункцию одноразовой пункционной иглой, в малой операционной, по всем правилам асептики и антисептики
Мы выполняем люмбальную пункцию одноразовой пункционной иглой, в малой операционной, по всем правилам асептики и антисептики.
 Исследование ликвора, люмбальная пункция. На приеме у врача невролога в клинике “Эхинацея”
Исследование ликвора, люмбальная пункция. На приеме у врача невролога в клинике “Эхинацея”
Исследования ликвора, в зависимости от цели исследования, может включать в себя:
- Исследование ликвора для подтверждения, либо исключения диагноза «Рассеянный склероз» – исследование олигоклонального IgG в ликворе.
- Общий анализ ликвора: белок, глюкоза, цитоз (количество и состав клеток), калий, натрий, хлор.
- Микроскопия ликвора на грибы, бактерии, атипичные клетки.
- Бактериологический посев ликвора.
- ПЦР – исследование из биоматериала ликвора на туберкулез, сифилис, токсоплазмоз, энтеровирусы (вирус полиомиелита входит в эту группу вирусов), цитомегаловирус, вирус герпеса 6 типа, вирус простого герпеса (1 и 2 типы), вирус Эпштейн-Барр, листерию, боррелию, хламидию трахоматис, вирус клещевого энцефалита и некоторые другие инфекции.
- Рассеянный склероз и рассеянный энцефаломиелит
- Хронические нейроинфекции, в т.ч. нейроборрелиоз, нейросифилис, туберкулез центральной нервной системы, герпетические инфекции, грибковые инфекции
- Дифференциальная диагностика бокового амиотрофического склероза и медленных нейроинфекций
- Нейросаркоидоз
- Нейролейкоз
Частым нормальным осложнением является постпункционная головная боль, это нормально и она может сохраняться до 1 недели. При возникновении головной боли Вы можете связаться с врачом и получить необходимые рекомендации.
Противопоказания к пересадке костного мозга
Противопоказания, в первую очередь, создают острые инфекционные заболевания, такие, как ВИЧ, гепатит В и гепатит С, сифилис, всевозможные нарушения иммунной системы, а также беременность. Не рекомендуется операция по замене стволовых клеток слабым физически и пожилым пациентам, а также строго противопоказана пациентам, страдающим тяжелыми заболеваниями внутренних органов. Противопоказания могут также создавать долговременная терапия с применением антибиотиков или гормональных препаратов.
Противопоказаниями к донорству стволовых клеток, является заболевание донора аутоиммунным или же инфекционным заболеванием. Наличие любого из заболеваний легко выясняется путем обязательного медицинского всестороннего обследования донора.
Но, сегодня по-прежнему самым серьезным препятствием при процедуре замены стволовых клеток, остается несовместимость донора и пациента. Очень маленький шанс найти подходящего и совместимого донора для трансплантации. Зачастую донорский материал берется либо у самого пациента, либо у его физиологически совместимых родственников.
Симптомы
Основные клинические проявления миелодиспластического синдрома неспецифические и являются следствием изменения количества клеток крови. В первую очередь это цитопенический синдром, то есть совокупность состояний, вызванных снижением количества определённых клеток в периферической крови. Могут быть отдельно выделены следующие синдромы:
- анемический синдром — возникает при снижении количества эритроцитов и\или гемоглобина. Включает в себя бледность кожных покровов и видимых слизистых оболочек, слабость, повышенную утомляемость, раздражительность, шум или звон в ушах, головокружение, одышку, возникновение сердцебиения даже при незначительной физической нагрузке, выпадение волос, изменения ногтей (исчерченность ногтевых пластинок, принятие ими ложкообразной формы). Также могут возникать заеды в углах рта, глоссит (налёт, чувство жжения в языке, потеря вкусовой чувствительности), извращение вкуса и запаха, в ряде случаев дизурические расстройства. Встречается у подавляющего количества больных.
- геморрагический синдром — возникает в результате снижения количества тромбоцитов. Проявляется повышенной кровоточивостью — появлением кровоизлияний в кожу и слизистые оболочки размерами от синячков до крупных гематом, кровотечений (носовых, маточных, из дёсен, желудочно-кишечных кровотечений) и кровоизлияний во внутренние органы (головной мозг, сетчатка, суставы).
- лейкопения — снижение количества лейкоцитов. Поскольку лейкоциты являются основным звеном клеточного иммунитета, то присоединяются инфекции, которые и обуславливают дальнейшую симптоматику. Довольно часто, примерно в половине случаев, встречается только изолированная нейтропения — снижение количества только одного вида лейкоцитов, нейтрофилов. Кроме того, наблюдается постепенное ослабление организма, повышение температуры, озноб, учащённый пульс, беспокойство, головные боли.
К иным симптомам относят:
- инфекционные осложнения,
- В-симптомы (лихорадка, ночные поты, потеря веса),
- Увеличение селезёнки,
- аутоиммунные проявления. В 10% случаев являются самыми первыми проявлениями миелодиспластического синдрома: возникает системный васкулит, некротический панникулит, серонегативный артрит, ревматическая полимиалгия, Кумбс-положительная гемолитическая анемия, перикардит, плеврит.
При этом нельзя не отметить, что у значительного количества больных относительно доброкачественными формами миелодиспластического синдрома долгое время может не проявляться вообще никаких симптомов, и в этом случае заболевание может быть случайной находкой, выявленной впервые при выполнении общего анализа крови.
Что такое костный мозг
Костный мозг для кроветворной системы является важнейшим органом, ведь его главная функция – как раз осуществление гемопоэза, или кроветворения. Он непосредственно участвует в создании новых клеток крови взамен тех, что погибли, отмерли. Кроме того, единственной тканью взрослого человека, в которой содержатся незрелые клетки, известные также как стволовые, является именно костный мозг.
Костный мозг бывает двух типов: желтый, который представлен преимущественно жиром, и красный – основной орган кроветворения. В отличие от красного, желтый костный мозг не принимает участия в гемопоэзе.
Во время гемопоэза образуются клетки крови. Стартует гемопоэз в раннем эмбриональном периоде. Соответственно, существуют как эмбриональные кроветворные органы, так и те, что функционируют после рождения. К органам, которые отвечают за гемопоэз во время эмбрионального периода, относят желточный мешок, фетальную печень, селезенку и костный мозг. В желточном мешке появляются первые кроветворные стволовые клетки. Происходит это на 3-й неделе эмбриогенеза. Незадолго после, от 3-го месяца и до рождения, основным кроветворным органом плода становится печень, поскольку некоторые из стволовых клеток перемещаются туда. С 4-го же месяца эмбриогенеза начинается формирование клеток крови и в костном мозге. Кроме того, в кроветворении у плода участвуют тимус, лимфатические узлы и селезенка. В печени и селезенке сохраняются гемопоэтические стволовые клетки, находящиеся в «спящем» состоянии, чем часто объясняют факт возникновения за пределами костного мозга очагов кроветворения. Такое кроветворение называется экстрамедуллярным. Возникает оно при онкологических заболеваниях крови и в результате чрезмерной стимуляции гемопоэза.
Объем костномозговых полостей у только что родившегося ребенка составляет около 1,6 л., из которых красный костный мозг занимает почти 100% пространства. Когда человек взрослеет, происходит централизация кроветворения, при этом гемопоэтически активная ткань сохраняется в костях центральной части скелета. Общий объем костного мозга у взрослых достигает приблизительно 4 л.
Расположение гемопоэтической ткани у взрослого человека следующее: в костях таза ее больше всего – 40%, в телах позвонков значительно меньше – 28%, в костях черепа она составляет 13%, в эпифизах трубчатых костей и ребрах – 8%, в грудине меньше всего – только 2%. Оставшуюся часть костномозговых полостей занимает желтый костный мозг, являющийся, как вы помните, жировой тканью. При этом красный и желтый костный мозг находятся в равном соотношении: 1:1.
Структурно красный костный мозг подразделяется на: экстраваскулярный (собственно, гемопоэтическая ткань) и васкулярный, который состоит из широких венозных сосудов, называемых синусами. В сети ретикулиновых волокон внутри костных трабекул находится желеподобный дисперсный материал, который и является гемопоэтической тканью.
Кровоснабжение костного мозга называется перфузией. Его осуществляют основная питающая артерия и ее малые терминальные артериолы. Отток же крови происходит таким образом: по венозным капиллярам собирается кровь в центральный венозный синус через венозные сосуды. Стенки венозных сосудов состоят из следующих трех слоев клеток: адвентиции, базальной мембраны и эндотелия. Именно в ретикулуме – тонкой сети волокон соединительной ткани, образованной отростками адвентициальных клеток, располагаются кроветворные клетки. На объем гемопоэтического пространства влияют изменения в адвентициальных клетках: количество кроветворных клеток снижается, когда адвентициальные клетки увеличиваются из-за повышения содержания в них жира. Если рассматривать эту картину под микроскопом, она выглядит как трансформация красного костного мозга в желтый.
В тот момент, когда требования к кроветворению повышаются – адвентициальные клетки уменьшаются, тем самым способствуя увеличению гемопоэтического компонента костного мозга.
Как происходит пересадка костного мозга?
Если подходящий донор найден, то за неделю до пересадки больному проводят процедуру кондиционирования — высокодозную химиотерапию. Кондиционирование нужно, чтобы уничтожить как можно большее число опухолевых клеток и подавить иммунитет, дабы снизить риск отторжения донорских клеток. Затем пациенту переливают клетки донора — эта процедура похожа на переливание крови.
Существует два способа взять у донора стволовые клетки: можно пожертвовать небольшое количество костного мозга из тазовой кости под наркозом. Эта процедура занимает около получаса. Другой способ — сдать клетки из периферической крови. Донор выпивает специальный препарат, который заставляет стволовые клетки выйти из костей в кровь, а затем сдает кровь из вены. Кровь из вены проходит через специальный прибор, который отделяет стволовые клетки, а затем возвращает кровь обратно в кровеносную систему. Процедура длится около пяти часов — долго, но зато без наркоза.
Через две-четыре недели врачи проверяют, прижились ли клетки и появились ли в крови пациента новые лейкоциты, эритроциты и тромбоциты.
В течение пары дней после процедуры донор может чувствовать легкое недомогание и снижение гемоглобина из-за забора крови. Примерно через две недели костный мозг донора полностью восстанавливается.
 РИА Новости / Алексей Куденко
РИА Новости / Алексей Куденко
https://img.anews.com/media/gallery/111228595/804038333.jpg
Исследование костного мозга и системы крови
Кровь состоит из основных видов клеток: эритроциты, тромбоциты, лейкоциты и их подвиды, а также системы свертывания крови. Красный костный мозг является производителем всех клеток крови. Красный костный мозг – это важный орган кроветворной системы в организме человека. Его главная функция – кроветворение (гемопоэз) т.е. создание новых клеток крови на замену отработавшим свой срок. Кроме этого, костный мозг очень важен для корректной работы иммунной системы, т.к. он участвует в образовании иммунных клеток. Кровь и костный мозг являются незаменимыми элементами человеческого организма. Любая «поломка» в этой системе будет негативно сказываться на здоровье и отразится в данных исследований. Утилизация «старых» кровяных клеток происходит с участием селезенки, поэтому при обследовании системы крови может понадобиться исследование размеров и структуры селезенки.
Обследование системы крови, в зависимости от того, что с ней происходит, можно построить по нескольким вариантам: можно обследовать эритроцитарный росток, тромбоцитарный росток, лейкоцитарный росток и систему свертывания крови по отдельности или в комбинациях, в зависимости от того, что явилось поводом к обследованию и что видно в результатах ранее выполненных анализов (повышение или понижение каких-то видов клеток крови, билирубина, увеличение селезенки и т.д.). Как правило, обследование системы крови начинается с того, что при лабораторных исследованиях по какой-то причине, было выявлено либо чрезмерно большое, либо чрезмерно малое количество одного или нескольких видов клеток крови или нарушение строения этих клеток (слишком маленькие, слишком большие, неправильной формы и т.д.).
- Для заболевания эритроцитарного ростка характерна анемия либо, наоборот, повышение гемоглобина и эритроцитов в крови. Анемия может быть по разным причинам, например, при нехватке витаминов (например, витамин В-12 дефицитная анемия), нехватке железа, при хронической кровопотере (длительные и обильные менструации, кисты яичников, которые наполняются кровью и т.п.). Появление анемии также может быть связано с чрезмерным разрушением клеток крови, в этом случае образуется большое количество билирубина и может увеличиваться селезенка.
- Обследование тромбоцитарного ростка может понадобиться при увеличении или уменьшении числа тромбоцитов. При снижении уровня тромбоцитов целесообразно выполнить исследования на аутоиммунные заболевания (аутоиммунная тромбоцитопения). При избытке тромбоцитов возрастает риск тромбозов и увеличивается вязкость крови. В этом случае можно выполнить исследование свертывающей системы крови и выясняется причина тромбоцитоза (увеличения количества тромбоцитов).
- Обследование лейкоцитарного ростка рекомендуется, когда в анализе крови увеличивается или уменьшается количество лейкоцитов (лимфоциты, моноциты, эозинофилы, нейтрофилы, базофилы). Когда лейкоцитов мало (лейкопения) – возможна аутоиммунная агрессия против костного мозга, тяжелая хроническая инфекция, общее истощение организма, иммунодефицит. Когда лейкоцитов слишком много, это может говорить, например, о наличии какого-то воспалительного процесса, онкологическом заболевании системы крови.
В нашей клинике Вы можете сдать анализы крови 7 дней в неделю
При обследовании на лейкозы (поражение лейкоцитарного ростка) может понадобиться исследование костного мозга и серия других продвинутых тестов для определения вида лейкозов. Также исследование костного мозга широко применяется при тяжелой анемии.
Подробнее об исследовании крови:
- Общий (клинический) анализ крови
- Биохимические анализы крови
- Коагулограмма. Анализ н
- а свертываемость и вязкости крови, риска тромбозов
- Анализы крови на тромбофилию, синдром Лейдена, дефект фолатного цикла. Анализы на антифосфолипидный синдром (АФС). Обследование на риск тромбообразования
- Иммунограмма – обследование иммунитета
- Онкомаркеры
3.Заболевания костного мозга
Все заболевания костного мозга относятся к тяжёлым, поскольку несут серьёзную угрозу жизни. Нарушения в составе крови снижают способность организма адекватно реагировать на угрозы, приходящие извне; усложняется поддержание внутренней стабильности организма; нарушается продуктивность происходящих процессов; возникает дефицит или чрезмерное накопление определённых веществ в органах и тканях; угнетаются иммунные и нервно-психические реакции.
По симптоматике и характеру нарушений выделяют основные заболевания костного мозга:
Апластическая анемия диагностируется, если происходит прекращение функционирования стволовых клеток. Поскольку они не обладают способностью к восстановлению и воспроизводству самих себя, позднее выявление этого заболевания очень опасно. Со временем красный костный мозг полностью замещается жировыми тканями. Причиной такого опасного заболевания, как правило, являются паразиты. Продукты жизнедеятельности гельминтов приводят к интоксикации, угнетающей стволовые клетки костного мозга; Железодефицитная анемия возникает при остром дефиците железа в организме. Причиной такого состояния могут стать большие кровопотери, плохое питание, а также болезни желудочно-кишечного тракта, при которых железо не усваивается, даже если пища разнообразна и включает железосодержащие продукты (яблоки, мясо, яйца, рыбу, печень, ягоды); Лучевая болезнь. Заболевание возникает в результате облучениями большими дозами радиоактивного и иных опасных излучений. Стволовые клетки мозга подвергаются столь серьёзному разрушительному воздействию, что это может стать началом опаснейших трудноизлечимых заболеваний. Экстренные меры здесь должны быть направлены на нейтрализацию воздействия и выведение из организма радиоактивных веществ; Острый лейкоз — нарушение иммунологического контроля над появляющимися время от времени клетками с мутациями. В норме иммунные механизмы вовремя выявляют образование клеток с опасными злокачественными нарушениями и уничтожают их, не давая возможности приступить к самовоспроизводству. Если появляются достаточно устойчивые раковые клетки или их образование под действием каких-то факторов слишком ускоряется, иммунные механизмы не справляются и позволяют клеткам-мутантам начать бесконтрольный рост и размножение. В результате здоровые клетки крови и костного мозга постепенно вытесняются больными, что очень опасно. Происходят нарушения во всех процессах жизнедеятельности, поскольку кровь уже не может в полной мере выполнять свои функции. Лишь своевременная диагностика и лечение дают больному шанс на выздоровление.
Костный мозг — это жизненно важный орган. Любые нарушения в его работе несут серьезную угрозу для всего организма. При малейшем подозрении на заболевание костного мозга нельзя медлить с обращением к врачу, поскольку чаще всего прогноз для таких больных напрямую зависит от стадии заболевания, на которой начато лечение.
4.Лечение болезни
До недавнего времени основным лечением при раке костного мозга была химиотерапия, основанная на введении в организм высокотоксичных веществ, которые разрушают злокачественные клетки, препятствуют их разрастанию и размножению. Это очень тяжёлый метод лечения с побочным негативным действием на весь организм. У больных вместе с раковыми клетками происходит разрушения здоровых клеток и тканей. Нарушения затрагивают сердце, желудочно-кишечный тракт, печень. Кости теряют кальций, становятся хрупкими. Страдают волосы, зубы, кожа.
Ещё одна методика лечения, дополняющая химиотерапию, – это лучевая терапия. Облучение также воздействует на все клетки организма – злокачественные и здоровые. Последствия такого воздействия остаются на всю жизнь.
Очаговые опухоли костных тканей удаляются хирургически. Оперативное лечение здесь сочетается с химиотерапией.
В терапии рака костного мозга, как и при всех онкологических заболеваниях, широко применяются поддерживающая гормонотерапия, симптоматические поддерживающие процедуры, уменьшающие негативные побочные эффекты от тяжёлого лечения. В ряде случаев показаны плазмаферез и переливание крови.
Современная медицина в последние годы предлагает ещё один метод лечения рака – пересадку костного мозга и пересадку стволовых клеток. Для многих пациентов это единственный путь к излечению. Хотя метод очень эффективный, его применение связано с двумя серьёзными проблемами: поиском донора и реабилитацией после процедуры. Материал для пересадки желательно брать у ближайших родственников. Если это невозможно, поиск костного мозга проводится в донорском банке. Несовпадение пересаживаемого материала донора и пациента имеет тяжелейшие последствия (от отторжения костного мозга до иммунной реакции самого донорского материала, который может начать атаковать своего «нового хозяина»). При совпадении основных характеристик костного мозга донора и пациента прогноз весьма благоприятный.
Как стать донором костного мозга и кто может это сделать?
Стать донором костного мозга может дееспособный человек от 18 до 55 лет, никогда не болевший гепатитом В или С, малярией, туберкулезом, онкологией, диабетом, психическими расстройствами и не являющийся носителем ВИЧ.
Аллогенные трансплантации бывают трех видов, в зависимости от того, кто дает свои клетки: совместимый родственный, совместимый неродственный и частично совместимый родственный донор. С вероятностью 25% совместимыми донорами для человека могут стать его родные братья или сестры — когда нужен донор именно их обследуют первыми.
Но стать донором костного мозга не так просто, ведь вероятность, что костный мозг донора подойдет пациенту — один к десяти тысячам. Если речь идет о родственниках, то шанс выше.
Чтобы стать донором и быть зачисленным в специальный регистр, нужно пройти процедуру типирования. При типировании у потенциального донора берут 5-10 миллилитров крови из вены, чтобы определить фенотип — особую генетическую формулу, которую заносят в специальный регистр. С помощью фенотипа можно выявить, с кем из реципиентов у донора возникнет совместимость тканей. На сайте «Русфонда» есть , где можно сдать кровь, чтобы попасть в Национальный регистр.
В регистре все имена потенциальных доноров зашифрованы особым образом и не могут быть раскрыты.
Может случиться и так, что донорские клетки не подойдут для пересадки никому.
 РИА Новости / Владимир Трефилов
РИА Новости / Владимир Трефилов
https://img.anews.com/media/gallery/111228595/305315636.jpg
Одна из главных проблем пересадки костного мозга в России — малое количество доноров в регистре — около 90 тысяч человек. Для сравнения: в США их около 10 миллионов, а в Германии — около 7 миллионов.
Вероятность, что человек сможет найти подходящего донора в российском регистре крайне мала, поэтому пациентам приходится обращаться в международные. «В российском регистре поиск донора стоит 150-300 тысяч рублей, а в зарубежных — 18 тысяч евро. Государство такой поиск не оплачивает, оплачивают фонды», — писал сайт «Такие Дела».
Есть и другая проблема: практически невозможно найти донора для представителей малочисленных народов, чьи предки веками жили обособленно, например, на Кавказе.
Оценка эффекта проведённого лечения
Значительное многообразие клинических проявлений различных заболеваний, объединённых в понятие «миелодиспластический синдром», затрудняет выработку общей шкалы, согласно которой возможно проводить оценку эффективности лечения. На данный момент применяется классификация IWG (International Working Group), которая включает следующие варианты:
- Полная ремиссия — в костном мозге выявляется не более 5% или 30×10 9 /л бластных клеток, в периферической крови уровень гемоглобина составляет более 110 г/л, число нейтрофилов 1,0×10 9 /л и более, бластные клетки не определяются,
- Частичная ремиссия — в костном мозге количество бластных клеток составляет более 5%, но снизилось на 50% и более от исходного значения, показатели периферической крови аналогичны критериям полной ремиссии,
- Костно-мозговая ремиссия — в костном мозге количество бластных клеток составляет более 5%, но снизилось на 50% и более от исходного значения,
- Стабилизация — отсутствие признаков частичной ремиссии и признаков прогрессирования заболевания в течение 8 недель,
- Цитогенетическая ремиссия — выделяют полную ремиссию, обязательным условием для которой является исчезновение исходных аномалий кариотипа и отсутствие вновь появившихся. Уменьшение количества клеток с хромосомными нарушениями на 50% и более расценивается как частичная цитогенетическая ремиссия.
Отдельно выделяют состояние, именуемое гематологическим улучшением. Для его установления необходимо, чтобы следующие критерии были выполнены и сохранялись не менее 8 недель:
- Эритроидный ответ. Исходно уровень гемоглобина составлял менее 110 г\л; при наличии ответа гемоглобин повышается на 15 единиц и более, снижается
необходимость в переливания эритроцитарной массы. - Нейтрофильный ответ. Исходное количество нейтрофилов составляет менее 1,0×10 9 /л. Наблюдается увеличение числа нейтрофилов более, чем на 100% от исходных значений, а абсолютное их число составляет более 0,5×10 9 /л.
- Тромбоцитарный ответ. Исходное количество тромбоцитов составляет менее 100×10 9 /л. Абсолютное число тромбоцитов должно увеличиться до 30×10 9 /л и более или же в случае, если исходный уровень тромбоцитов составлял менее 20, увеличиться до 20×10 9 /л и минимум вдвое.
Прогрессирование заболевания также устанавливается согласно определённым критериям:
- снижение количества гранулоцитов или тромбоцитов минимум на 50% от максимального значения за всё время течения заболевания,
- снижение уровня гемоглобина на 20 г\л и более,
- увеличение бластных клеток на 50% и более,
- появление зависимости от переливания клеток,
- усугубление цитопении при стабильных показателях бластных клеток.
Трансформация в острый миелоидный лейкоз констатируется при обнаружении в пунктате костного мозга или периферической крови более 20 % бластных клеток.
Васкуляризация. Иннервация. Возрастные изменения. Регенерация.
Васкуляризация. Костный мозг снабжается кровью посредством сосудов, проникающих через надкостницу в специальные отверстия в компактном веществе кости. Войдя в костный мозг, артерии разветвляются на восходящую и нисходящую ветви, от которых радиально отходят артериолы. Сначала они переходят в узкие капилляры (2—4 мкм), а затем в области эндоста продолжаются в широкие тонкостенные с щелевидными порами синусы (диаметром 10—14 мкм). Из синусов кровь собирается в центральную венулу. Постоянное зияние синусов и наличие щелей в эндотелиальном пласте обусловливаются тем, что в синусах гидростатическое давление несколько повышено, так как диаметр выносящей вены меньше по сравнению с диаметром артерии. К базальной мембране с наружной стороны прилежат адвентициальные клетки, которые, однако, не образуют сплошного слоя, что создает благоприятные условия для миграции клеток костного мозга в кровь. Меньшая часть крови проходит со стороны периоста в каналы остеонов, а затем в эндост и синус. По мере контакта с костной тканью кровь обогащается минеральными солями и регуляторами кроветворения.
Кровеносные сосуды составляют половину (50%) массы костного мозга, из них 30% приходится на синусы. В костном мозге разных костей человека артерии имеют толстую среднюю и адвентициальную оболочки, многочисленные тонкостенные вены, причем артерии и вены редко идут вместе, чаще врозь.
Капилляры бывают двух типов: узкие 6—20 мкм и широкие синусоидные (или синусы) диаметром 200—500 мкм. Узкие капилляры выполняют трофическую функцию, широкие являются местом дозревания эритроцитов и выхода в кровоток разных клеток крови. Капилляры выстланы эндотелиоцитами, лежащими на прерывистой базальной мембране.
Иннервация. В иннервации участвуют нервы сосудистых сплетений, нервы мышц и специальные нервные проводники к костному мозгу. Нервы проникают в костный мозг вместе с кровеносными сосудами через костные каналы. Далее покидают их и продолжаются как самостоятельные веточки в паренхиме в пределах ячеек губчатого вещества кости. Они ветвятся на тонкие волоконца, которые либо вновь вступают в контакт с костномозговыми сосудами и оканчиваются на их стенках, либо заканчиваются свободно среди клеток костного мозга.
Возрастные изменения. Красный костный мозг в детском возрасте заполняет эпифизы и диафизы трубчатых костей и находится в губчатом веществе плоских костей. Примерно в 12—18 лет красный костный мозг в диафизах замещается желтым. В старческом возрасте костный мозг (желтый и красный) приобретает слизистую консистенцию и тогда называется желатинозным костным мозгом. Следует отметить, что этот вид костного мозга может встречаться и в более раннем возрасте, например при развитии костей черепа и лица.
Регенерация. Красный костный мозг обладает высокой физиологической и репаративной регенерационной способностью. Источником образования гемопоэтических клеток являются стволовые клетки, находящиеся в тесном взаимодействии с ретикулярной стромальной тканью. Скорость регенерации костного мозга в значительной мере связана с микроокружением и специальными ростстимулирующими факторами гемопоэза.
Некоторые термины из практической медицины:
- миелограмма (миело- + греч. gramma запись) — выраженный в форме таблицы или диаграммы результат микроскопии мазка пунктата костного мозга, отражающий качественный и количественный состав ядросодержащих клеток миелоидной ткани.;
- миелоидная реакция (миело- + греч. —eides подобный) — появление в периферической крови малодифференцированных клеток, относящихся к грануло- и эритропоэтическому ряду; наблюдается при метастазах злокачественной опухоли в костный мозг, а также при сепсисе, туберкулезе и некоторых других болезнях;
- остеомиелит (osteomyelitis; остео- + греч. myelos костный мозг + ит; син.: костоеда — устар., паностит) — воспаление костного мозга, обычно распространяющееся на компактное и губчатое вещество кости и надкостницу;
| Часть первая – Общая характеристика, классификация; красный костный мозг | immunesys1.mp37 122 кБ |
| Часть вторая – Вилочковая железа — тимус | immunesys2.mp35 310 кБ |
| Часть третья – Селезенка | immunesys3.mp36 073 кБ |
| Часть четвертая – Лимфатические узлы, лимфоидная ткань слизистых оболочек | immunesys4.mp37 152 кБ |
Дифференциальная диагностика
В силу того, что цитопения может возникать при широком спектре заболеваний, необходимо исключить остальные возможные причины. В первую очередь это онкологические заболевания, включая гематологические, особенно с метастазированием в костный мозг
Особое внимание следует уделять уже выявленным и леченным ранее опухолям, так как угнетение костного мозга может быть следствием проведённых ранее химиотерапии, лучевой терапии и трансплантации костного мозга. Далее, в силу частой манифестации миелодиспластического синдрома аутоиммунными процессами необходимо исключить собственно аутоиммунные заболевания (например, системную красную волчанку, аутоиммунный тиреоидит, аутоиммунные гемолитические анемии)
Следующей важной причиной развития угнетения костного мозга могут быть хронические инфекционные заболевания — туберкулёз, малярия, гепатиты В и С, ВИЧ, носительство вируса Эпштейна—Барр. Немаловажно также исключить ряд других заболеваний, связанных с нарушением гемопоэза — В12/фолатдефицитные анемии, врождённую дизэритропоэтическую анемию, пароксизмальную ночную гемоглобинурию, анемию Фанкони (у молодых пациентов)
Наконец, необходимо помнить, что ряд вредных факторов, которые не только могут предрасполагать к развитию миелодиспластического синдрома, но и сами по себе вызывать снижение показателей крови, как-то: отравление бензином, свинцом и другими тяжёлыми металлами; дефицит меди и/или избыточном поступлении цинка с пищей.
Важно помнить, что при отсутствии таких достоверных критериев, таких, как наличие достаточного количества бластных клеток и характерных аномалий кариотипа, диагноз миелодисплатического синдрома является диагнозом исключения, который требует не только динамического исследования костного мозга, но и тщательного исключения всех остальных причин развившейся симптоматики
Осложнения при пересадке костного мозга. «Трансплантат против хозяина»
К сожалению, донорские клетки приживаются не всегда. Случается, что пересаженные донорские клетки производят лимфоциты, которые реагируют на ткани нового хозяина враждебно, поражая кожу, слизистые оболочки, кишечник и печень. Такая реакция называется «трансплантат против хозяина» (РТПХ). Эта реакция лечится препаратами, угнетающими иммунитет, из-за чего больной становится уязвим перед любыми вирусами. Иногда при развитии отторжения больному дополнительно вводят донорские клетки или ищут другого донора. При этом вероятность летального исхода для пациента составляет примерно 50%.
 РИА Новости / Борис Кауфман
РИА Новости / Борис Кауфман
https://img.anews.com/media/gallery/111228595/684975481.jpg